Latihan 3
Chapter 7
1. Jumlah orbital dalam subkulit 2p adalah ….
A. 2B. 3
C. 6
D. 10
E. 14
B. 1s 2s 2p 3s 3p 4s 3d 4p 4d
C. 1s 2s 2p 3s 3p 4s 3d 4p 5s
D. 1s 2s 2p 3s 3p 3d 4s 4p 5s
E. 1s 2s 2p 3s 3p 4s 4d 4p 5s
B. Heisenberg
C. Max Planck
D. Schrodinger
E. Wolfgang Pauli
A. 1s22s22p22p64s2
B. 1s22s22p63s23p6
C. 1s22s22p63s13p4
D. 1s22s22p63s13p6
Quis 3
1. Berdasarkan susunan kimianya, materi dikelompokkan menjadi tiga berikut ini, kecuali ….
a. unsur
b. senyawa
c. campuran
d. zat
e. molekul
2. Berikut ini yang merupakan kelompok unsur non logam adalah ….
a. hidrogen, nitrogen, dan oksigen
b. natrium, magnesium, dan alumunium
c. karbon, fosfor, dan kalium
A. (26 , 26) : (88 , 88)
B. (26 , 26) : (88 , 138)
C. (26 , 30) : (88 , 138)
D. (26 , 30) : (88 , 266)
E. (26 , 56) : (88 , 138)
Caranya ;
2. Lambang suatu unsur ![]() dapat disimpulkan bahwa pada satu atom unsur X mempunyai. . .
dapat disimpulkan bahwa pada satu atom unsur X mempunyai. . .
A. 18 neutron dan 18 proton
B. 22 neutron dan 22 proton
C. 40 proton dan 18 elektron
D. 18 proton dan 22 neutron
E. 18 neutron, 22 proton, dan 22 elektron
Caranya :
Nomor atom suatu unsur menunjukkan banyaknya proton atau banyaknya elektron. Sedangkan banyaknya neutron adalah Nomor Massa dikurangi
Nomor Atomnya.
![]() berarti unsur tersebut mempunyai 18 proton dan 18 elektron, dan (40 – 18) = 22 neutron.
berarti unsur tersebut mempunyai 18 proton dan 18 elektron, dan (40 – 18) = 22 neutron.
Chapter 3
1. Sebanyak 4,0 gram cuplikan yang mengandung senyawa hidrokarbon dibakar sempurna dengan gas oksigen. Jika presentase (%) massa karbon dalam cuplikan tersebut adalah 30%, maka massa karbon dioksida yang dihasilkan dalam proses pembakaran tersebut adalah.... (Ar C = 12, O = 16)
A. 3,3
B. 4,4
C. 5,4
D. 5,5
E. 6,0
Caranya :
dengan menganggap massa sebelum = massa sesudah reaksi, maka massa C dalam cuplikan akan sama dengan massa C dalam CO2. Sehingga:
2. Dalam setiap 100 gram urea (CO(NH2)2) terdapat 42 gram nitrogen. Persentase kemurnian dari pupuk urea tersebut adalah....
(diketahui Ar N = 14, C = 12, O = 16, H = 1)
A. 5 %
B. 40 %
C. 45 %
D. 80 %
E. 90 %
Caranya :
Mr CO(NH2)2 = Ar C + Ar O + 2xAr N + (4xAr H)
Mr CO(NH2)2 = 12 + 16 + 2x14 + (4x1)
Mr CO(NH2)2 = 60

Chapter 4
1. Untuk mengukur derajat keasaman asam atau basa yang akurat, paling tepat menggunakan. . . .
a. Fenolftalein
b. Metil jingga
c. pH meter
d. Bromtimol biru
e. Universal
2. Reaksi Redoks :
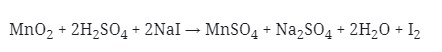
Yang berperan sebagai oksidator pada reaksi di atas adalah . . .
a. NaI
b. H2SO4
c. Mn2+
d. I–
e. MnO2
Chapter 5
1. Gas ideal berada dalam ruang tertutup dengan volume V, tekanan P dan suhu T. Apabila volumenya mengalami perubahan menjadi 1/2 kali semula dan suhunya dinaikkan menjadi 4 kali semula, maka tekanan gas yang berada dalam sistem tersebut menjadi….
A. 8 P1
B. 2 P1
C. 1/2 P1
D. 1/4 P1
E. 1/8 P1
Caranya :
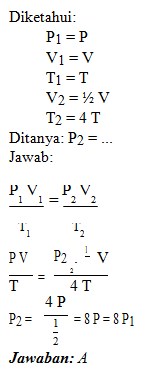
2. Sebanyak 3 liter gas Argon bersuhu 27°C pada tekanan 1 atm( 1 atm = 105 Pa) berada di dalam tabung. Jika konstanta gas umum R = 8,314 J mol−1 K−1 dan banyaknya partikel dalam 1 mol gas 6,02 x 1023 partikel, maka banyak partikel gas Argon dalam tabung tersebut adalah…..
A. 0,83 x 10²³ partikel
B. 0,72 x 10²³ partikel
C. 0,42 x 10²³ partikel
D. 0,22 x 10²³ partikel
E. 0,12 x 10²³ partikel
Caranya :
Chapter 6
1. Suatu campuran pereaksi di dalam tabung reaksi meyebabkan tabung tersebut menjadi panas jika dipegang. Penyataan yang tepat mengenai hal tersebut adalah….
a. Entalpi pereaksi bertambah
b. Entalpi peraksi berkurang
c. Entalpi pereaksi dan hasil reaksi bertambah
d. Entalpi pereaksi lebih besar daripada entalpi hasil reaksi
e. Entalpi hasil reaksi lebih besar daripada entalpi pereaksi
2. Jika diketahui:
![]()
Perubahan entalpi pada penguraian 1 mol gas NH3 menjadi unsur-unsurnya adalah….
a. -92 kJ
b. -46 kJ
c. +46 kJ
d. + 184 kJ
e. + 92 kJ
Caranya :
Dalam soal di atas dapat dilihat merupakan pembentukan reaksi. Pada dasarnya, perubahan entalpi penguraian standar merupakan kebalikan dari perubahan entalpi pembentukan standar, maka nilainya pun akan berlawanan tandanya.
Tapi pada reaksinya NH3 memiliki 2 mol sehingga jika diminta 1 mol nya, 92 sehingga pada 1 mol NH3 menjadi +46
Chapter 8
1. Energi ionisasi pertama, kedua, dan ketiga untuk unsur Na (dalam kJ/mol) adalah ....
(A) 496, 4.560, dan 6.900
(B) 578, 1.820, dan 2.750
(C) 736, 1.450, dan 7.730
(D) 786, 1.580, dan 3.230
(E) 1.012, 1.904, dan 2.190
Caranya :
Na merupakan unsur yang terletak pada golongan 1A dengan konfigurasi elektron 1s2 2s2 2p6 3s1 (2-8-1). Stabil ketika ia melepaskan elektron pertama (membentuk Na+) konfigurasi elektron Na 2-8.
Bila suatu spesi stabil (biasa elektron valensinya 8 seperti pada Na+) maka diperlukan energi yang besar untuk melepaskan lagi elektron yang dimiliki. Ini ditandai dengan energi ionisasi yang melonjak sangat besar dari sebelumnya.
2. Letak unsur dan konfigurasi elektron yang tepat untuk unsur 19X adalah…(nomor atom Ar = 18)
A. Periode 4, golongan IA, [Ar] 4s1
B. Periode 1, golongan IB, [Ar] 4d1
C. Periode 1, golongan IIA, [Ar] 4s2
D. Periode 2, golongan IIB, [Ar] 4d2
E. Periode 3, golongan IVA, [Ar] 4s2 3d2
Caranya :
menentukan letak unsur
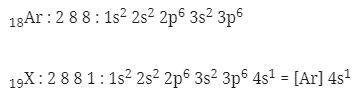
n = 4 → periode 4
eval = 1 → golongan IA
Chapter 9
1. Unsur yang mengikat dua electron untuk mendapatkan konfigurasi electron yang stabil adalah ….
a. 11Na
b. 14Si
c. 16S
d. 19K
e. 20Ca
Caranya :
a.11Na, memiliki konfigurasi elektron “2, 8, 1”, dengan 1 elektron valensi akan mudah melepas 1 elektron dan membentuk ion Na⁺
b.14Si, memiliki konfigurasi elektron “2, 8, 4”, dengan 4 elektron valensi sehingga membentuk ikatan kovalen
c.16S, memiliki konfigurasi elektron “2, 8, 6”, dengan 6 elektron valensi akan mudah mengikat 2 elektron dan membentuk ion S²⁻
d.19K, memiliki konfigurasi elektron “2, 8, 10, 1”, dengan 1 elektron valensi akan mudah melepas 1 elektron dan membentuk ion K⁺
e.20Ca, memiliki konfigurasi elektron “2, 8, 10, 2”, dengan 2 elektron valensi akan mudah melepas 2 elektron dan membentuk ion Ca²⁺
2. Diketahui nomor atom unsur:
A= 3 D= 12
B= 4 E= 9
C= 11 F= 17
Ikatan paling ionic dapat terbentuk antara ….
a. A dengan E
b. A dengan F
c. C dengan E
d. C dengan F
e. B dengan F
Chapter 10
1. Manakah molekul yang memiliki gaya tarik-menarik dipol-dipole antarmolekulnya? (Gunakan tabel periodik yang tersedia)
- AsH3
- BCl3
- Cl2
- CO2
- XeF4
- dipol-dipol
- ion-ion
- ikatan hidrogen
- ion-dipol
- gaya dispersi.
A. Gaya antar molekul
B. Gaya tarik-menarik dipol-dipol
C. Gaya induksi
D. Gaya dispersi
E. Gaya London
2. Diantara senyawa berikut yang memiliki gaya London adalah ….
A. CHCl3
B. H2O
C. CH4
D. NH3
E. HCl
Chapter 12
1. Sifat koligatif larutan adalah sifat yang bergantung pada ….
a. Jenis zat terlarut
b. Jenis zat pelaut
c. Jumlah zat pelarut
d. Jumlah zat terlarut
e. Konsentrasi larutan
2. Larutan fruktosa dengan konsentrasi 1,476 M mempunyai massa jenis 1,2 g/ml. Berapa kemolala larutan adalah …. (Mr fruktosa = 180)
a. 1,75 mol/kg
b. 1,87 mol/kg
c. 1,77 mol/kg
d. 1,85 mol/kg
e. 1,90 mol/kg
Caranya :
Basis perhitungan 1 L larutan fruktosa
Kemolalan laerutan fruktosa, m = n fruktosa / w air x 1.000
Diketahui, dalam 1 L larutan
– mol fruktosa, n Fruktosa = 1,476 mol
– menghitung massa air, w air = w larutan –w froktosa
Massa larutan
= ρ x V
= 1,1 g/Ml x 1000 ml
= 1100 g
Massa fruktosa = n fruktosa x Mm
= 1,476 mol x 180 g/mol
= 265,6 g
Diperoleh w air = w larutan – w fruktosa = 1100 g – 265,6 g = 834,4 g
Jadi, kemolalan larutan fruktosa
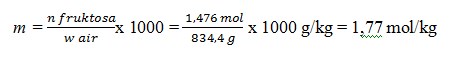





No comments:
Post a Comment